Le modèle atomique de Rutherford
Suite à la découverte du rayonnement radioactif (Bequerel,
Curie), Rutherford s'intéresse à ces nouveaux types
d'expériences afin d'explorer l'intérieur de la matière. Il
décide donc d'envoyer des particules ALPHA sur une mince feuille
métallique.
Vers 1900, on se représentait les atomes sous la forme de
sphères perméables. En 1909 Rutherford, avec Geiger et Marsden,
ont testé la validité de cette théorie dans son expérience,
maintenant célèbre, de la feuille d'or.
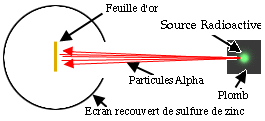 Cette expérience est assez simple : une
source radioactive émet un flux de particules alpha qui vient
bombarder une très fine feuille d'or (les particules alpha ont
très peu de masse comparés aux atomes d'or). Un écran
recouvert de sulfure de zinc entoure cette feuille d'or, de telle
façon que les particules alpha qui heurtent l'écran laissent de
microscopiques taches sur le sulfure de zinc.
Cette expérience est assez simple : une
source radioactive émet un flux de particules alpha qui vient
bombarder une très fine feuille d'or (les particules alpha ont
très peu de masse comparés aux atomes d'or). Un écran
recouvert de sulfure de zinc entoure cette feuille d'or, de telle
façon que les particules alpha qui heurtent l'écran laissent de
microscopiques taches sur le sulfure de zinc.
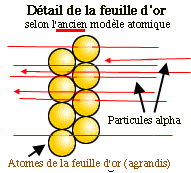 Le but de cette expérience était de justifier la
théorie selon laquelle les atomes seraient élémentaires.
Rutherford espérait que les particules alpha chargées et de
forte énergie n'auraient aucun problème pour traverser quelques
atomes. Les particules alpha devaient continuer leur trajectoire
en ligne droite, à travers la pellicule d'or, et ne laisser sur
l'écran qu'une petite région couverte d'impacts.
Le but de cette expérience était de justifier la
théorie selon laquelle les atomes seraient élémentaires.
Rutherford espérait que les particules alpha chargées et de
forte énergie n'auraient aucun problème pour traverser quelques
atomes. Les particules alpha devaient continuer leur trajectoire
en ligne droite, à travers la pellicule d'or, et ne laisser sur
l'écran qu'une petite région couverte d'impacts.
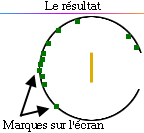
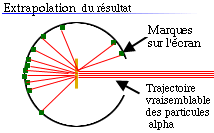 En fait, l'écran présentait des points
d'impact sur toute la surface de l'écran derrière la cible. Et,
à la surprise de tous, quelques impacts apparurent même en
avant de la cible.
En fait, l'écran présentait des points
d'impact sur toute la surface de l'écran derrière la cible. Et,
à la surprise de tous, quelques impacts apparurent même en
avant de la cible.
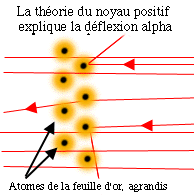 Le raisonnement que fit Rutherford est que la
majorité des particules alpha a facilement traversé la partie
externe de l'atome, mais que quelques-unes ont rebondi sur
quelque chose de petit, dense et de charge positive à
l'intérieur de l'atome.Bien que cela contredise l'hypothèse des
atomes élémentaires, ces résultats lui ont permis d'émettre
une nouvelle hypothèse : les atomes possèdent un constituant,
le noyau. Ce nouveau modèle qui explique les résultats est la
clé de voûte du développement de la théorie atomique moderne.
Le raisonnement que fit Rutherford est que la
majorité des particules alpha a facilement traversé la partie
externe de l'atome, mais que quelques-unes ont rebondi sur
quelque chose de petit, dense et de charge positive à
l'intérieur de l'atome.Bien que cela contredise l'hypothèse des
atomes élémentaires, ces résultats lui ont permis d'émettre
une nouvelle hypothèse : les atomes possèdent un constituant,
le noyau. Ce nouveau modèle qui explique les résultats est la
clé de voûte du développement de la théorie atomique moderne.
 Cette expérience est assez simple : une
source radioactive émet un flux de particules alpha qui vient
bombarder une très fine feuille d'or (les particules alpha ont
très peu de masse comparés aux atomes d'or). Un écran
recouvert de sulfure de zinc entoure cette feuille d'or, de telle
façon que les particules alpha qui heurtent l'écran laissent de
microscopiques taches sur le sulfure de zinc.
Cette expérience est assez simple : une
source radioactive émet un flux de particules alpha qui vient
bombarder une très fine feuille d'or (les particules alpha ont
très peu de masse comparés aux atomes d'or). Un écran
recouvert de sulfure de zinc entoure cette feuille d'or, de telle
façon que les particules alpha qui heurtent l'écran laissent de
microscopiques taches sur le sulfure de zinc. Le but de cette expérience était de justifier la
théorie selon laquelle les atomes seraient élémentaires.
Rutherford espérait que les particules alpha chargées et de
forte énergie n'auraient aucun problème pour traverser quelques
atomes. Les particules alpha devaient continuer leur trajectoire
en ligne droite, à travers la pellicule d'or, et ne laisser sur
l'écran qu'une petite région couverte d'impacts.
Le but de cette expérience était de justifier la
théorie selon laquelle les atomes seraient élémentaires.
Rutherford espérait que les particules alpha chargées et de
forte énergie n'auraient aucun problème pour traverser quelques
atomes. Les particules alpha devaient continuer leur trajectoire
en ligne droite, à travers la pellicule d'or, et ne laisser sur
l'écran qu'une petite région couverte d'impacts.
 En fait, l'écran présentait des points
d'impact sur toute la surface de l'écran derrière la cible. Et,
à la surprise de tous, quelques impacts apparurent même en
avant de la cible.
En fait, l'écran présentait des points
d'impact sur toute la surface de l'écran derrière la cible. Et,
à la surprise de tous, quelques impacts apparurent même en
avant de la cible. Le raisonnement que fit Rutherford est que la
majorité des particules alpha a facilement traversé la partie
externe de l'atome, mais que quelques-unes ont rebondi sur
quelque chose de petit, dense et de charge positive à
l'intérieur de l'atome.Bien que cela contredise l'hypothèse des
atomes élémentaires, ces résultats lui ont permis d'émettre
une nouvelle hypothèse : les atomes possèdent un constituant,
le noyau. Ce nouveau modèle qui explique les résultats est la
clé de voûte du développement de la théorie atomique moderne.
Le raisonnement que fit Rutherford est que la
majorité des particules alpha a facilement traversé la partie
externe de l'atome, mais que quelques-unes ont rebondi sur
quelque chose de petit, dense et de charge positive à
l'intérieur de l'atome.Bien que cela contredise l'hypothèse des
atomes élémentaires, ces résultats lui ont permis d'émettre
une nouvelle hypothèse : les atomes possèdent un constituant,
le noyau. Ce nouveau modèle qui explique les résultats est la
clé de voûte du développement de la théorie atomique moderne.