Le modèle
atomique de Rutherford et Bohr
Le modèle de l'atome de Rutherford était constitué de deux
types de particules. Les charges positives appelées protons
concentrées dans un noyau et les charges négatives appelées
électrons qui gravitent autour de l'atome. Cependant, ce modèle
possède plusieurs faiblesses. Comment des protons de charges
positives peuvent-ils rester collées dans un noyau dont le
diamètre ne dépasse pas 1 x 10-14mètre si la loi
des charges s'appliquent.
La découverte du Neutron
James Chadwick découvrit le neutron en 1932.Ces particules
qui séjournent dans le noyau de l'atome étaient considérées
comme la colle qui pouvait unir les protons dans un noyau. La
masse de cette particule est de 1.76 x 10-27 Kg et
comme son nom le dit, elle est neutre.
Tableau des particules :
| Particules |
Découvreur |
Année |
Charge |
Masse kg |
Masse U |
Position
|
| Electrons |
JJ Thomson
|
1897
|
-1
|
9.01 x 10 -31 |
0.0005
|
Gravitent autour du noyau |
| Protons |
Rutherford
|
1919
|
+1
|
1.672 x 10 -27 |
1
|
Dans le noyau
|
| Neutrons |
J.Chadwick
|
1932
|
0
|
1.674 x 10 -27 |
1
|
Dans le noyau
|
Modèle atomique de Bohr.
Même si le modèle de Rutherford pouvait expliquer certains
phénomènes comme le déplacement des charges négatives dans
l'électricité statique, ce modèle possédait quelques lacunes.
On ne pouvait pas expliquer les différentes sortes de lumière
(spectre) que nous observions lorsque les atomes étaient
excités. Neils Bohr établit que les électrons devaient ou
pouvaient graviter sur des orbites différentes autour du noyau
de l'atome.
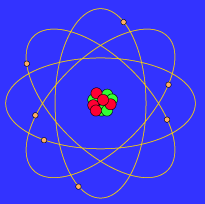
Bohr a beaucoup travaillé sur le modèle de l'hydrogène car
c'était l'atome le plus simple. Il possède 1 proton dans son
centre et 1 électron qui gravite autour de l'atome afin de
conserver la neutralité (en charge) de celui-ci. Il s'aperçoit
que lorsque électron absorbe de l'énergie il gravite sur une
autre orbitale plus éloignée du noyau. Mais lorsque l'électron
retomba sur son orbite original, il émet de la lumière
(photon).
