La masse atomique des
éléments
dans le tableau périodique.
Vous savez que les atomes sont constitués de protons, électrons
et neutrons. Donc, quelle serait la masse en Kg d'un atome
d'hélium ?
Comme vous avez pu le voir, cette masse est
très petite. Il serait alors difficile de travailler avec ces
chiffres pour les 109 atomes et les millions de composés. c'est
pourquoi un accord international a été conclu en 1961 pour que
le Carbone-12, (6 protons et 6 neutrons) soit le point de
référence. On lui accorde une masse atomique de 12.00000 U.
L'unité de masse atomique (U) est donc le 1/12 de la masse
atomique du carbone. Pour transformer la masse des atomes en Kg,
il faut savoir que 1 U = 1.66 10 E -27 Kg.
Il ne faut pas oublier que la masse atomique d'un élément est
une masse relative dont la valeur sera toujours comparée à la
masse du carbone-12. Donc, en regardant la masse de l'hélium
nous pouvons voir qu'il est 3 fois moins lourd que le carbone.
Donc, pour savoir la masse des atomes nous les avons tous
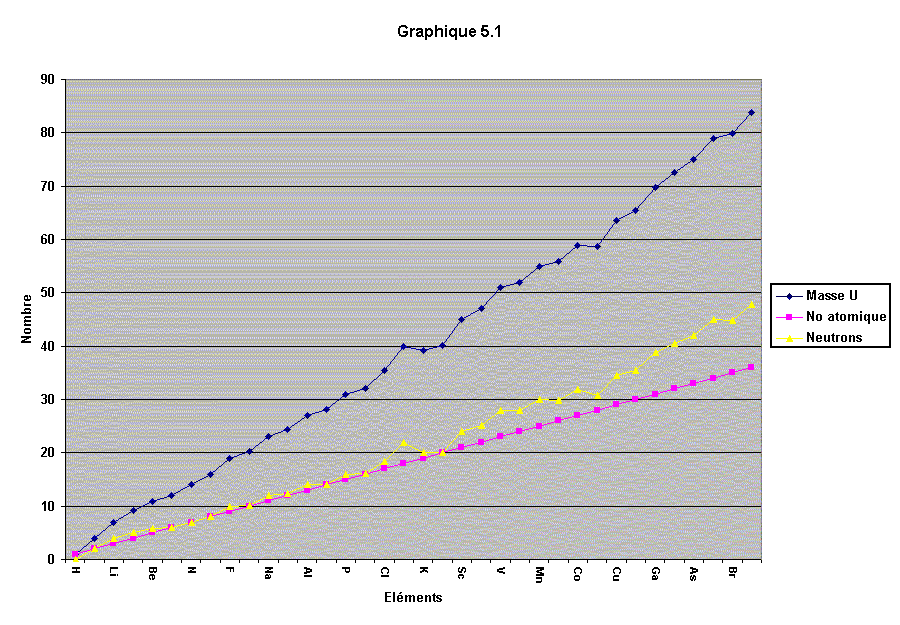
comparés les uns aux autres. Voici un graphique de la
progression de la masse en fonction du numéro atomique pour les
36 premiers éléments.

Comme vous avez pu le constater la variation de la masse est simplement due au nombre de neutrons car le nombre de protons augmente toujours de 1. Là où il y a des imperfections sur l'augmentation du nombre de neutrons, nous pouvons voir ce même phénomène aussi sur la progression de la masse. Car la masse est la somme des protons et des neutrons.